▼▼▼▼▼▼▼▼ ▼▼▼▼▼▼▼▼
お問合せはこちら セミナー詳細こちら
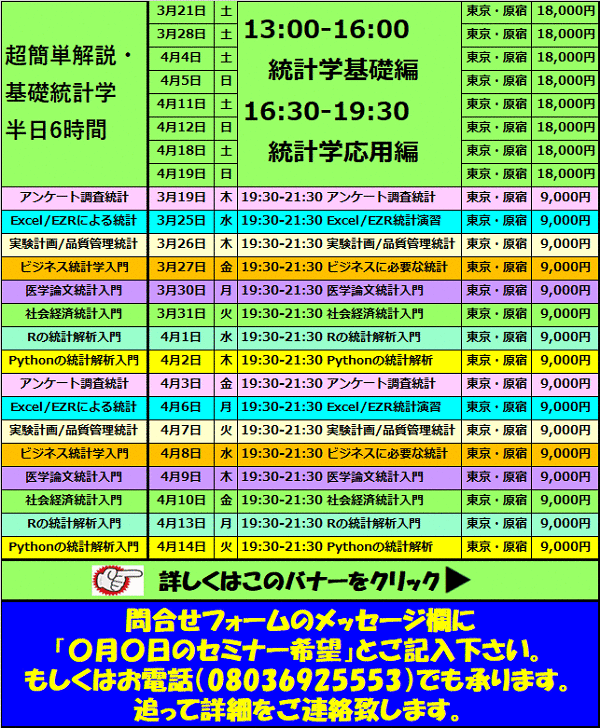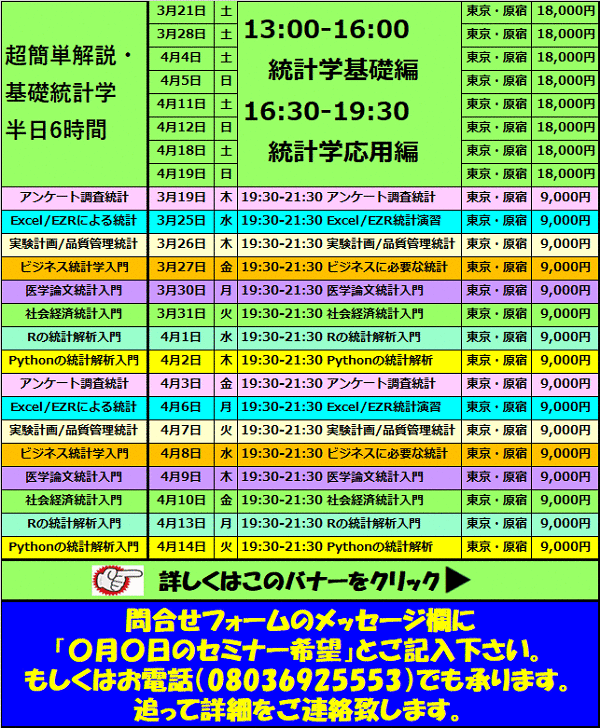
医療統計学:GCP省令
医療統計学、医療経済学、数学のつぼをたとえ話でわかりやすく解説
運営者の20年以上にわたる医療統計学のノウハウを満載
医療統計学:GCP省令
治験を実施する際に守るべきルールをGCP(Good Clinical Practice)といいます。
GCPは国際的に合意された臨床試験の実施に関する基準をもとにして、日本の環境を踏まえて日本で正しく治験を実施できるように厚生労働省により省令(法律を補う規則)として定められています。
GCPでは、治験を実施する医療機関、人の役割や業務を詳細に決めており、治験を実施する場合は、それを守らなければなりません。
新しいくすりを開発している製薬会社が、そのくすりや疾患の専門家の医師と協議して、治験の実施計画を作成します。
計画にあたっては、専門の医師と製薬会社との間で、人権や安全性の保護、科学的に適切かどうか等が協議されます。
治験に参加する医師はこのようにして作成された治験の実施計画を確認・合意して治験を実施することになります。
なお、治験の実施計画は、治験を開始するまでに厚生労働省に届けることになっています。
治験の計画に予め決めておかなければならないことが「治験の実施に関する省令(GCP)」に定められています。主な内容は以下のとおりです。
①治験の依頼をしようとする者(製薬会社等)の氏名及び住所
②治験を行う医療機関の名称及び所在地
③治験を行う医師の氏名及び職名
④治験の目的
⑤治験で用いるお薬の概要
⑥治験の実施方法
⑦治験への参加条件
⑧治験に関する記録の保存に関すること など
治験審査委員会は、治験を依頼した製薬会社や治験を実施する医師等とは独立した第三者的な機関として設置されています。
治験を計画通りに実施することができるか、参加される患者さんの治療に不利益にならないか等を事前に取り決めた手順書に従って、治験を開始する前に確認しています。
また、治験実施中に、治験が正しく実施されているか確認したり、安全性に問題がないかを評価し、治験を継続すべきか判断したりしています。
治験審査委員会の設置者は、通常の手続きに関する手順書等を作成し、その手順書(SOP:Standard Operating Procedure)に従って業務を行わせなければならないことが「治験の実施に関する省令(GCP)」に定められています。
治験審査委員会はIRB(Institutional Review Board)と略されることもあります。
治験審査委員会の委員は、医学等の専門家、専門家以外の委員、病院の職員以外の委員等から構成されています。
治験を適切に審議及び評価するために委員会は5人以上の委員から構成され、「医学等の専門家の委員」、「医学等の専門家以外の委員」、「治験実施医療機関及び治験審査委員会の設置者と利害関係を有しない委員」がいなければなりません。
治験審査委員会で治験の実施計画を審査した内容は、平成21年4月より、治験審査委員会の手順書、委員名簿と併せて「会議の記録の概要」を公表することが義務付けられています。
製薬会社の治験担当者や監査担当者は、医療機関が治験を実施計画書とおりに行っているか、患者さんのカルテや記録類をそれぞれの立場から確認しています。厚生労働省は、医療機関や製薬会社の治験を審査の観点から、調査します。このような仕組みで治験の信頼性を保証しています。
国際共同治験は、米国や欧州やアジア圏などの複数の国又は地域で、世界共通の基準のもと、くすりの効果と安全性を確認するのに必要な項目を統一した実施計画で同時に実施します。世界中の多くの患者さんが参加することになります。
★★統計学目次★★

▼▼▼▼▼▼▼▼ ▼▼▼▼▼▼▼▼
お問合せはこちら セミナー詳細こちら
医療統計学:GCP省令 関連ページ
- 医療統計学:医師主導治験
- 医療統計学:実臨床における問題
- 医療統計学がわかりにくい理由
- 医療統計学の現状と教育の重要性
- 医療統計学をマスターするには努力が必要
- 医療統計学は作業しながら勉強する
- 医療統計学の学習における時間管理法
- 医療統計学:人に教えることを意識する
- 医療統計学で扱う数値
- 医療統計学:統計は「どんな人」でも使える
- 医療統計学:「どんなとき」に使うかを理解する
- 医療統計学:統計で会社や製品への信頼感が増す
- 医療統計学:「どんなメリット」があるかを押さえる
- 医療統計学:統計は万能ではなく、限界もある
- 医療統計学:データ収集にはいろいろな手段がある
- 医療統計学:母集団と標本を理解する
- 医療統計学:データは2種類に分類できる
- 医療統計学:データの形式で手法にちがいがある
- 医療統計学:データを処理する手順を知る
- 医療統計学:見やすい階級をつけて集計する
- 医療統計学:グラフをつくりその特性を読み取る
- 統計学は難しくない